作者
作者  通讯作者
通讯作者
基因组学与应用生物学, 2011 年, 第 30 卷, 第 37 篇 doi: 10.5376/gab.cn.2011.30.0037
收稿日期: 2011年06月01日 接受日期: 2011年06月30日 发表日期: 2011年07月03日
引用格式(中文):
王玉等, 2011,茶树抗寒基因连锁的ISSR标记及其SCAR标记的初步建立,基因组学与应用生物学(online), Vol.30 No.37 pp.1238-1243 (doi: 10.5376/gab.cn.2011.30.0037)
引用格式(英文):
Wang et al., 2011, The initial establishment of ISSR and SCAR markers of cold resistance gene linked in camellia sinenesis, Jiyinzuxue Yu Yingyong Shengwuxue (Genomics and Applied Biology), Vol.30 No.37 pp.1238-1243 (doi: 10.5376/gab.cn.2011.30.0037)
本研究以‘黄山种’自然杂交后代幼苗为试材,采用ISSR技术和集群分类法初步筛选与茶树抗寒基因连锁的分子标记,在27对引物中有10对引物可以在两基因池中扩增多态性条带。将获得的特异条带进行克隆测序,根据序列信息设计特异引物,将ISSR标记转化为SCAR标记。通过在供试茶树单株中验证发现,其中2个SCAR标记在供试材料有良好的多态性。这些ISSR转化来的SCAR标记将为今后‘黄山种’茶树种质资源的抗寒性鉴定和抗寒良种的选育提供新的工具。
茶树(Camellia sinensis),属山茶科(Theaceae)山茶属(Camellia),是多年生常绿木本植物,原产于热带及亚热带地区,是一种喜温暖湿润条件的叶用植物。近年来,随着人们生活水平的提高,饮食消费观念逐渐向天然化、营养化、保健化的方向发展,由于茶叶中含有大量对人体有保健功效的成分,从而备受亲睐。茶叶需求量随之增加,茶树种植面积不断扩大,种植区不断北移。低温寒害成为茶树生长过程中面临的重要自然灾害之一(杨亚军等, 2005)。如何提高茶树的抗寒性成为近年来研究的热点。而茶树的抗寒性是茶树长期适应低温胁迫过程中逐步发展形成的一种对寒害的抵抗能力。茶树的抗寒性具有遗传性,这种遗传性是植物抗寒能力彼此区别的内因,对植物抗冻、抗冷能力起决定作用。因此,选育抗寒良种,利用茶树自身的遗传因素来抵御低温胁迫是解决这一问题最根本的方法。
由于茶树为多年生木本植物,选育一个良种耗时长,从优良单株入选到较大面积推广,至少需要10年甚至更长的时间。因此,茶树种质资源抗寒性的早期鉴定对抗寒良种的选育具有十分重要的意义。研究者通过测定叶片解剖结构(王玉等, 2009)、质膜透性(黄海涛等, 2009, 浙江农业科学, (3): 577-579)、保护性酶类(Vyas and Kumar, 2005)等指标来鉴定茶树的抗寒性。但表型鉴定工作量大,耗时长,难以高效率的筛选出抗性种质。要提高筛选效率,最理想的方法是能够直接对基因型进行选择,分子标记为实现对基因型的直接选择提供了可能。抗寒性相关的分子标记已在高粱(Knoll and Ejeta, 2008)、马铃薯(Vega et al., 2003)、水稻(Suh et al., 2010)和葡萄(张剑侠等, 2010)等作物有相关报道。
ISSR标记因其具有良好的稳定性和多态性,已广泛应用于遗传多样性、品种鉴定、遗传图谱构建等方面的研究。利用ISSR标记来寻找特定性状分子标记也在辣椒(王述彬等, 2009),苜蓿(王瑜等, 2008),黄瓜(陈学好等, 2008)等作物上有相关报道,但在茶树上尚未见相关报道。
本研究在生理指标鉴定茶树的抗寒性基础上,利用ISSR分子标记结合BSA (bulked separate analysis)方法的原理,初步筛选出与茶树抗寒性相关的分子标记,并将其转化成SCAR (sequence characterized amplified region)标记,为今后分子标记辅助育种,加快茶树抗寒良种的选育提供新的途径和方法。
1结果与分析
1.1茶树种质资源抗寒性的鉴定
根据测得茶树单株的电导率、可溶性糖含量、可溶性蛋白的含量,得到茶树单株的抗寒指数,见表1。从表1中可以看出供试茶树单株在各个生理指标中,都有一定的遗传变异,其中质膜透性的变异最小为5.7%,可溶性糖含量的变异最大为20.4%,各测定指标的分布接近正态分布。
|
|
根据抗寒指数的频率分布图(图1),结合田间鉴定。对茶树的抗寒性进行分级,抗寒指数大于5.75的单株为极抗寒型,共4株。小于4.75的单株为极敏感型,共4株。
|
|
1.2 ISSR引物的筛选及扩增
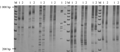
根据优化的ISSR扩增体系和程序对抗寒型和敏感型基因池进行PCR扩增,6%聚丙烯酰胺凝胶检测产物,结果显示(图2),所用27对ISSR引物,均能在两个基因池中扩增出清晰谱带。扩增的DNA条带大小在100~1 500 bp之间。在27对引物中,有10对引物可以在两个基因池中扩增差异条带。挑选其中具有多态性的引物在供试茶树单株中进行扩增,如图3为引物IR18在供试单株的扩增产物多态性。从图3中可以看出从两个基因池中筛选的差异条带在供试的茶树单株中同样存在多态性。
|
|
|
|
1.3差异片段的序列比对分析结果
对可以在两个基因池中稳定扩增的10条差异条带进行回收测序。将序列信息提交NCBI进行BLASTN和BLASTX比对分析(表2),结果发现15#与马铃薯(Solanum bulbocastanum)的钙依赖性蛋白激酶相似性为93%[E value=7e-8],并与蒺藜苜蓿(Medicago truncatula)的5号染色体基因组序列有82%的相似性[E value=1e-22]。43#与拟南芥(Arabidopsis thaliana)的假定蛋白有70%相似性[E value=8e-07],51#与紫花苜蓿(Medicago sativa)的LEA蛋白有79%的相似性[E value=1e-05],且与干旱诱导的蒺藜苜蓿的EST序列有85%的相似性 [E value=5e-11],其余片段序列未发现与GenBank中已有基因序列有较高的同源性。
|
|
1.4 SCAR标记的开发
根据ISSR差异条带的DNA序列设计引物,建立8个与茶树抗寒连锁的SCAR标记(表3)。经在供试茶树单株DNA样品的PCR扩增,发现其中SCAR51 (图4),SCAR15在供试单株中可扩增多态性,且抗寒单株大多数出现条带,敏感型未出现条带或条带较弱。其余SCAR标记在扩增中没有扩增出多态性,在供试样品中均扩增出大小相同的DNA片段。
|
|
|
|
2讨论
由于茶树为异花授粉作物,自交不亲和,具有丰富的遗传多样性(陈亮等, 1998)。用ISSR引物扩增产生的共有条带较少,产物间表现出很大的差异,提高了筛选标记的困难。本研究利用BSA法的原理,构建了抗寒与敏感的DNA池。在构建的DNA池中只有目标基因是经过选择而其余的成分是随机的,遗传背景可认为是相同或相近的。因而在两池中表现差异的DNA分子标记,很有可能与目标性状相连锁,降低了筛选ISSR标记的难度。
研究中获得的大多数差异条带未发现与GenBank中已有基因序列有较高的同源性。这可能是由于这些片段为基因间或基因的内含子序列,而非表达的DNA序列。其中有两条DNA序列与已知植物抗逆基因有部分同源性。胚胎发育晚期丰富蛋白(late embryogenesis abundant protein, LEA)是生物体中广泛存在的一类与渗透调节有关的家族蛋白。其不仅在植物胚胎发育晚期表达量丰富,而且在环境胁迫如干旱、低温、盐胁迫、ABA、紫外辐射和NaHCO3等条件下mRNA也会大量积累, 被认为是在胁迫过程中对植物起保护作用的物质之一(Zhao et al., 2010; 钱刚等, 2007)。钙依赖性蛋白激酶(calcium-dependent protein kinase / calmodulin-like domain protein kinase, CDPK)是植物和某些原生生物所特有的一类丝氨酸/苏氨酸蛋白激酶。在植物的碳/氮代谢、离子和水分跨膜运输、细胞骨架调节、气孔运动调节、生长发育过程中均有CDPK的参与。低温、干旱、损伤、盐胁迫、营养缺乏等物理和化学压力均可使CDPK基因的表达增强(Cheng et al., 2002; 太帅帅等, 2009)。
相对于ISSR标记,SCAR标记可以直接检测差异位点,一般情况下电泳结果显示为条带的有无或大小的差异,更容易鉴别。因此,将ISSR标记转化为SCAR标记是极有意义的工作。但很多研究发现SCAR标记的转化率是很低的,往往会出现PCR扩增失败或PCR产物多态性消失(郭霞等, 2009;Shirasawa et al., 2004; Xiao et al., 2009 )。本研究在转化SCAR标记的时候也发现许多引物扩增多态性消失。这可能是由于在ISSR引物的基础上向内延伸数个碱基后,减少了引物位点错配的发生,从而导致了多态性的消失,也可能是ISSR扩增了大小相同的非特异性条带,但由于浓度低未检测出,从而误以为是多态性条带。因此,在今后的研究中还应进一步优化实验条件,设计多对引物,从而获得更为理想的结果。
3材料和方法
3.1材料
供试茶树种质资源为青岛农业大学日照种质资源圃07年播种的‘黄山种’自然杂交后代幼苗,2009年秋季取茶树单株一芽二叶,液氮速冻后于-80℃冰箱保存,提取DNA备用。2009年冬季取茶树单株中部成熟叶片进行抗寒性生理指标的测定。
3.2茶树种质资源抗寒性的鉴定
质膜相对透性的测定方法:取新鲜茶树叶片,每组用打孔器打成12个叶圆片,放入洁净的试管中,加10 mL去离子水,放于真空干燥器中用真空泵抽气10 min,缓慢放入空气,叶片变成透明状,间隔几分钟振荡一次,在室温下保持30 min。用电导仪测定外渗液的电导值,之后将试管放入沸水中10 min以杀死组织,冷却至室温后再次测定外渗液的电导值。
可溶性糖的测定:取新鲜茶树叶片,剪碎混匀,称取0.2 g,放入刻度试管中,加入10 mL蒸馏水,塑料薄膜封口,于沸水中提取30 min (提取2次),提取液过滤入25 mL容量瓶中,反复漂洗试管及残渣,定容,采用硫酸蒽酮比色法测定可溶性糖含量
可溶性蛋白的测定:称取新鲜茶树叶片0.5 g,用5 mL蒸馏水研磨成匀浆后,3 000 r/min离心10 min,取上清液1.0 mL (视蛋白质含量适当稀释)于试管中,采用考马斯亮蓝进行比色。
参照洪永聪等(2009)方法计算叶片的茶树抗寒生理指数,从表型上鉴定茶树单株的抗寒性。
3.3 ISSR分析
茶树基因组DNA的提取采用改良的CTAB法(刘本英, 2009),取抗寒生理指数最高和最低的各4株茶树DNA分别等量混合,组成敏感型(sensitive)/抗寒型(resistance)的基因池,进行差异条带的筛选。ISSR引物序列,扩增体系和反应程序参照姚明哲等(2007)的方法。
3.4特异片段的克隆测序和SCAR标记的开发
用灭菌手术刀片直接从聚丙烯酰胺凝胶上割取目的条带,浸泡于50 μL ddH2O中过夜,95℃水浴10 min,5 000 r/min离心5 min。取2 μL上清液为模板进行PCR扩增,反应条件与原条件相同。琼脂糖电泳检测PCR产物,然后对目的条带进行回收,克隆,菌液送上海英骏生物技术有限公司测序,用BLAST程序进行序列比对。
根据测序结果,通过Primer Premier 5.0软件设计SCAR引物,以供试茶树单株基因组DNA为模板进行PCR扩增,程序为94℃预变性5 min;94℃变性30 s,55~60℃复性30 s,72℃延伸30 s,35个循环;72℃延伸8 min。PCR扩增产物在1.2%琼脂糖凝胶上分离检测。
作者贡献
王玉是本研究的实验完成人,进行了实验设计,样品采集,数据统计及论文写作。范凯参与了实验,进行数据分析等工作。丁兆堂为本论文的通讯作者,指导实验设计,数据分析,论文写作。全体作者都阅读并同意最终的文本。
致谢
感谢中国农科院茶叶研究所陈亮、姚明哲等老师的指导和帮助。感谢匿名同行评审人的评审意见和修改意见。
参考文献
Cheng S.H., Willmann M.R., Chen H.C., and Sheen J., 2002, Calcium signaling through protein kinases. The Arabidopsis calcium-dependent protein kinase gene family, Plant Physiology, 129(2): 469-485 doi:10.1104/pp.005645 PMid:12068094 PMCid:1540234
Chen X.H., Wang J., Xu Q., Ji Y., and Liang G.H, 2008, An ISSR marker linked to the parthenocarpic gene of cucumber, Fenzi Zhiwu Yuzhong (Molecular Plant Breeding), 6(1): 85-88 (陈学好, 王佳, 徐强, 嵇怡, 梁国华, 2008, 一个与黄瓜单性结实基因连锁的ISSR标记, 分子植物育种, 6(1): 85-88)
Guo X, Zhang Y, and Liu Z.Y., 2009, Development of sex linked AFLP-derived SCAR markers in Carica payapa, Zhongguo Nongye Kexue (Scientia Agricultura Sinica), 42(3): 967-973 (郭霞, 张艳, 刘志勇, 2009, 番木瓜性别连锁的AFLP及其SCAR标记的建立, 中国农业科学, 42(3): 967-973)
Hong Y.C., Wang Y. Ding Z.T., and Zhang X.F., 2009, Cold resistant screening of tea germplasm resources applied by physiological index of leaves in wintering period, Zhongguo Nongxue Tongbao (Chinese Agricultural Science Bulletin), 25(16): 215-218 (洪永聪, 王玉, 丁兆堂, 张新富, 2009, 越冬期茶树叶片生理指数分析及抗寒种质材料的筛选, 中国农学通报, 25(16): 215-218)
Knoll J., and Ejeta G., 2008, Marker-assisted selection for early-season cold tolerance in sorghum: QTL validation across populations and environments, TAG Theoretical and Applied Genetics, 116(4): 541-553 doi:10.1007/s00122-007-0689-8 PMid:18092147
Liu B.Y., 2009, Application studies of EST-SSR and ISSR markers in tea germplasms (Camellia spp.) from Yunnan, Dissertation for Ph.D., Chinese academy of Agricutural Sciences, Supervisor: Cheng H., pp.13-15 (刘本英, 2009, EST-SSR和ISSR分子标记在云南茶树资源中的应用研究, 博士学位论文, 中国农业科学院, 导师: 成浩, pp.13-15)
Qian G., Zhai X.G., Han Z.X., Pan Z.F., Deng G.B., and Yu M.Q., 2007, Cloning and sequence analysis of novel drought-tolerance gene coding LEA3 protein in Tibetan Hulless barly, Zuowu Xuebao (Acta Agronomica Sinica), 33(2): 292-296 (钱刚, 翟旭光, 韩兆雪, 潘志芬, 邓光兵, 余懋群, 2007, 西藏青稞LEA3蛋白新抗旱基因的克隆与序列分析, 作物学报, 33(2): 292-296)
Shirasawa K., Kishitani S., and Nishio T., 2004, Conversion of AFLP markers to sequence-specific markers for closely related lines in rice by use of the rice genome sequence, Molecular Breeding, 14(3): 283-292 doi:10.1023/B:MOLB.0000047791.94870.40
Suh J.P., Jeung J.U., Lee J.I., Choi Y.H., Yea J.D., Virk P.S., Mackill D.J., and Jena K.K., 2010, Identification and analysis of QTLs controlling cold tolerance at the reproductive stage and validation of effective QTLs in cold-tolerant genotypes of rice (Oryza sativa L.), TAG Theoretical and Applied Genetics, 120(5): 985-995 doi:10.1007/s00122-009-1226-8 PMid:20012263
Tai S.S., Liu G.S., Sun Y.H., and Chen J., 2009, Cloning and expression of calcium-dependent protein kinase (CDPK) gene family in Nicotiana tabacum, Zhongguo Nongye Kexue (Scientia Agricultura Sinica), 42(10): 3600-3608 (太帅帅, 刘贯山, 孙玉合, 陈珈, 2009, 普通烟草CDPK基因家族的克隆及表达分析, 中国农业科学, 42(10): 3600-3608)
Vega S.E, del Rio A.H., Jung G., Bamberg J.B., and Palta J.P., 2003, Marker-assisted genetic analysis of non-acclimated freezing tolerance and cold acclimation capacity in a backcross Solanum population, American Journal of Potato Research, 80(6): 359-369 doi:10.1007/BF02854247
Wang S.B., Wu X.L., Liu J.B., and Pan B.G., 2009, The ISSR markers linked to CMV resistant gene in hot pepper, Fenzi Zhiwu Yuzhong (Molecular Plant Breeding), 7(3): 569-572 (王述彬, 吴小丽, 刘金兵, 潘金贵, 2009, 辣椒抗黄瓜花叶病毒(CMV)基因的ISSR标记, 分子植物育种, 7(3): 569-572)
Wang Y., Hong Y.C., Ding Z.T, Zhang X.F., Wang Y., and Fan K., 2009, Cold resistance prediction of tea germplasm resources applied by anatomical structure index of leaves, Zhongguo Nongxue Tongbao (Chinese Agricultural Science Bulletin), 25(9): 126-130 (王玉, 洪永聪, 丁兆堂, 张新富, 王漪, 范凯, 2005, 利用茶树叶片解剖结构指数预测茶树种质材料的抗寒性, 25(9): 126-130)
Xiao J.P., Chen L.G., Xie M., Liu H.L., and Ye W.Q., 2009, Identification of AFLP fragments linked to seedlessness in Ponkan mandarin (Citrus reticulata Blanco) and conversion to SCAR markers, Scientia Horticulturae, 121(4): 505-510 doi:10.1016/j.scienta.2009.03.006
Yang Y.J., Zheng L.Y., and Wang X.C., 2005, Changes of membrane fatty acid composition and protein in tea leaves at low temperature, Yaredai Zhiwu Kexue (Subtropical Plant Science), 34(1): 5-9 (杨亚军, 郑雷英, 王新超, 2005, 低温对茶树叶片膜脂脂肪酸和蛋白质的影响, 亚热带植物科学, 34(1): 5-9)
Yao M.Z., Chen L., Wang X.C., Zhao L.P., and Yang Y.J., 2007, Genetic diversity and relationship of clonal tea cultivars in China revealed by ISSR markers, Zuowu Xuebao (Acta Agronomica Sinica), 33(4): 598-604 (姚明哲, 陈亮, 王新超, 赵丽萍, 杨亚军, 2007, 我国茶树无性系品种遗传多样性和亲缘关系的ISSR分析, 作物学报, 33(4): 598-604)
Zhang J.X., Xiong Y., Wang Y.J., and Zhu Z.G., 2010, RAPD markers linked to the hardiness gene in Chinese wild Vitis and their sequence analysis, Zhongguo Nongxue Tongbao (Chinese Agricultural Science Bulletin), 26(10): 30-37 (张剑侠, 熊燕, 王跃进, 朱自果, 2010, 中国野生葡萄抗寒基因的RAPD标记及其序列分析, 中国农学通报, 26(10): 30-37)
Zhao X., Zhan L.P., and Zou X.Z., 2011, Improvement of cold tolerance of the half-high bush Northland blueberry by transformation with the LEA gene from Tamarix androssowii, Plant Growth Regulation, 63(1): 13-22 doi:10.1007/s10725-010-9507-4
Chen L., Yang Y.J., Yu F.L., Gao Q.K., Chen D.M., 1998, Genetic devisity of 15 tea (Camellia sinensis (L.) O. Kuntze) cultivars using RAPD markers, Chaye Kexue (Journal of Tea science), 18(1): 21-27 (陈亮, 杨亚军, 虞富莲, 高其康, 陈大明, 1998, 15个茶树品种遗传多样性的RAPD分析, 茶叶科学, 18(1): 21-27)
Vyas D., and Kumar S., 2005, Tea (Camellia sinensis (L.) O. Kuntze) clone with lower period of winter dormancy exhibits lesser cellular damage in response to low temperature, Plant Physiology and Biochemistry, 43(4): 383-388 PMid:15907690
Wang Y., Yuan Q.H., and Gao J.M., 2008, Analysis of ISSR markers associated with brown blot resistance gene in Alfalfa, Zhongguo Caodi Xuebao (Chinese Journal of Grassland), 30(3): 65-68 (王瑜, 袁庆华, 高建明, 2008, 苜蓿褐斑病抗性基因ISSR标记研究, 中国草地学报, 30(3): 65-68)